编辑|修竹书生
前言哺乳动物的着床前发育结合了为胎儿建立一小群创始人细胞和胚胎外组织的早期分化,以促进着床、模式形成和营养。
转录和翻译机制被激活,从母体主导的受精卵中建立自给自足的细胞群。
一旦建立,胚胎谱系必须免受过早分化,以保持易受随后的位置和时间模式的影响,以协调体内所有组织的形成。这种特性被称为多能性。
小鼠植入前外胚层的一个有趣的和生物医学相关的资产,是当它以胚胎干细胞的形式移植到适当的培养条件下时,它能够保持未分化和增殖。
受精卵能够产生所有的胚胎和胚胎外谱系。这种独特的能力被称为全能性。然而,哺乳动物的全能性准备早在受精之前就已经开始了。
在小鼠中,发育中的卵母细胞的体积在卵巢内生长过程中增加了约500倍。
在成熟的卵母细胞中,母体基因组的连续转录产生约100pg的信使RNA,一些转录本仍处于休眠状态,以便在受精后被激活。
相比之下,精子在发育过程中失去了大部分的细胞器,以换取活力,因此它依赖于卵子来启动胚胎基因组。
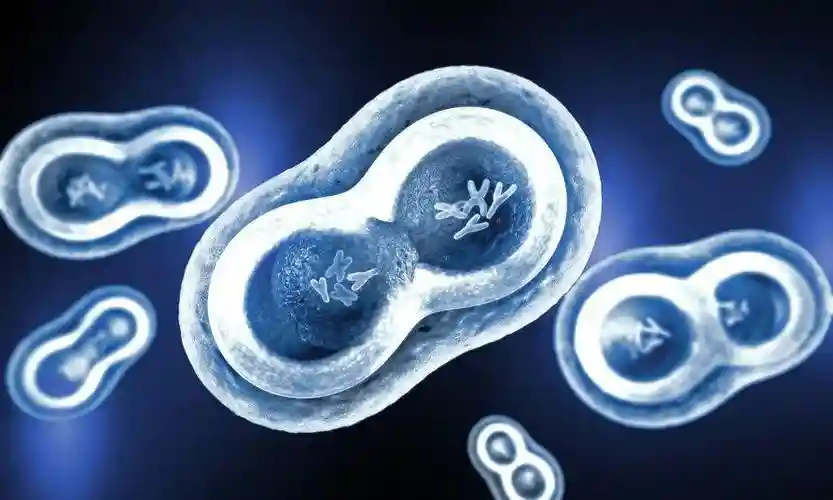
受精后,母体蛋白和转录本为小鼠中2细胞阶段的第一波主要转录铺平了道路,并继续进行在发展的初始阶段发挥作用。
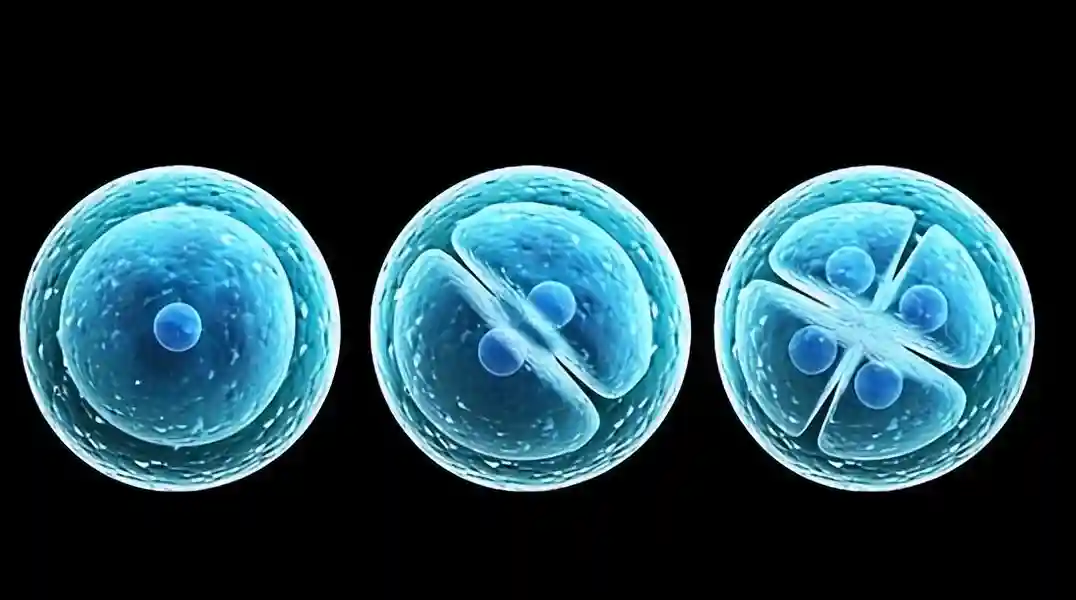
前五个细胞周期,通常被称为分裂,其特征是主要的s相,而g相存在,但短和可变的。裂解发生在没有细胞生长或细胞总质量增加的情况下,并严格依赖于受精卵的大胞质室。由卵裂分裂产生的细胞被称为卵裂球。
在2细胞阶段,卵裂球保留了形成完整概念的能力,从同卵双胞胎的形成中可以明显看出,并在两个卵裂球中的一个被破坏后,小鼠产生可存活的后代得到证明。
同卵双胞胎是一种罕见的现象,最近的研究表明,至少需要建立4个着床前外胚层细胞才能成功地正常发育。

此外,通过调节成纤维细胞生长因子和Wnt信号传递,可以提高同卵双胞胎的生长效率。
4细胞和8细胞阶段的单个囊胚球也可以在发育过程中进展,形成滋养细胞囊泡和小囊胚,当转移到同步受体时可以植入子宫。
然而所产生的蜕膜大多含有滋养层巨细胞,只有一次是发育迟缓的胚胎,这表明单个1/4和1/8的囊胚球不能单独产生整个胎儿。
从4和8细胞阶段分离的卵裂球与来自另一个胚胎的宿主卵裂球聚集的实验表明,它们能够分化为滋养外胚层和内细胞团,并产生活的幼崽。
因此,它们无法孤立地形成一个正常的胎儿,很可能是由于细胞数量不足,而不是由于发育潜力的限制。
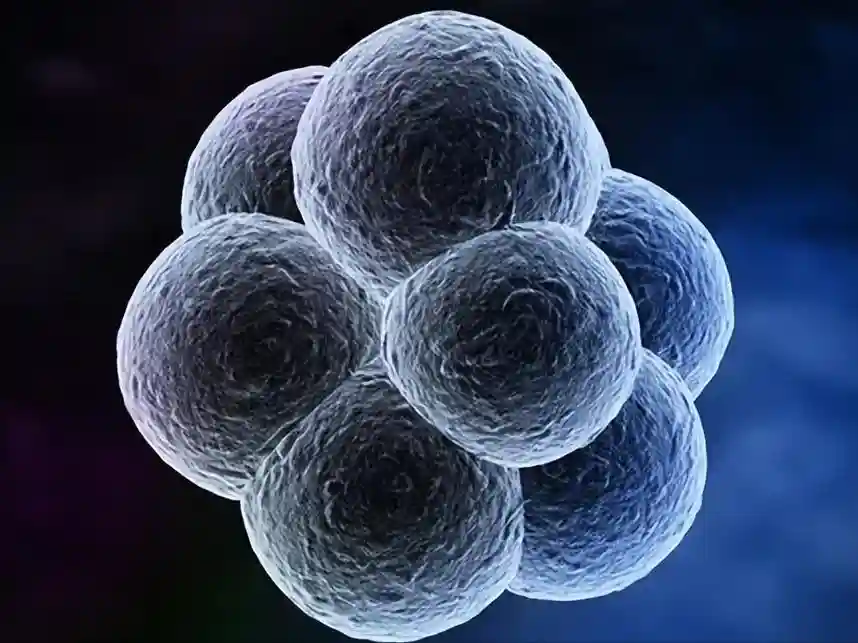
所有来自4细胞和8细胞阶段的卵裂球都参与了胚胎外和胚胎谱系,这一事实证明了它们的主要等效性。
发育生物学中最有趣的问题之一是,如何从明显统一的8细胞卵裂球中获得谱系身份。一个可能的答案是,早期的卵裂球可能不像它们看起来那样相同。
一些研究强调了单个卵裂球之间的差异,包括差异甲基化模式在特定条件下的效力和转录因子动力学。
然而大多数卵裂球保留了胚胎和胚胎外的潜能,并根据其在8-16个细胞的胚胎中的位置进行分化。
卵裂球体是如何“感知”它们的位置?
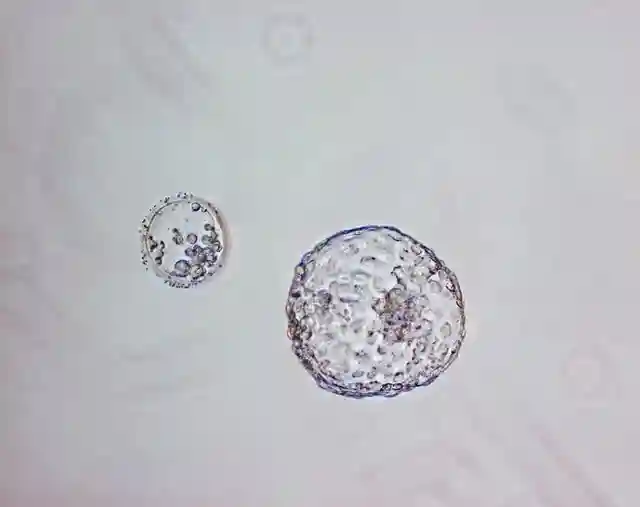
在第一个谱系决定之前的一个关键事件是压缩,它发生在8个细胞阶段的后期,大约在2.75个胚胎日。
在压实过程中,卵裂球增加了它们在细胞间的相互作用,从而为哺乳动物胚胎的第一个谱系决定提供了必要的空间队列。这允许建立不同的隔间。
最初被表述为“内外”假说,随后的实验证实了单个囊胚的空间位置对其后续的谱系分配具有指导意义。在正常发育过程中,桑葚胚的外细胞偏向于第一个胚胎外谱系,即滋养外胚层。
滋养层需要植入,随后会产生胎盘,胎盘是一个胚胎外器官,对营养、解毒和发育中的胎儿的模式至关重要。
相反,位于内部的细胞倾向于形成早期囊胚的内细胞团。内细胞团细胞维持pou结构域转录因子Oct4的表达,这在外部细胞中下调。
在没有Oct4的情况下,内部细胞无法保持其身份并分化为滋养层。利用胚胎干细胞,研究表明Oct4与Sox2协同作用,诱导多个多能性基因的表达,包括纤维细胞生长因子4和Nanog。
与此相一致的是,单细胞分辨率的胚胎谱显示Sox2和Id2分别是内外细胞的最早标记,在16和32细胞期特异性上调。
在压实过程中,细胞间粘附依赖于e-钙粘蛋白,而细胞外通过极性蛋白非典型蛋白激酶C、Par3和肌动蛋白相关蛋白ezrin的不对称定位获得顶端-基底极性。
RNAi微注射干扰极性调节因子,干扰滋养层发育,将极化置于胚胎中第一个谱系决定的上游,但位于单个囊胚的“内外”空间位置的下游。这种极性在中第一个谱系决定的“极性”模型中特别考虑了该极性。
该模型的关键是,胚胎在致密的桑葚胚阶段变得径向极化,最初是通过在每个囊胚球上形成一个外部微绒毛极而发现的。
该模型表明,这种极性可以在下一次分裂过程中继承,因为大多数卵裂球会产生一个极性细胞,它继承了外表面,以及一个非极性细胞,完全被其他卵裂球吞噬。其余的细胞通过分裂微绒毛的顶端区域来对称分裂,从而产生两个极化的子细胞,这两个子细胞都有一个外表面。
这个模型与平均16个细胞胚胎的形态一致,其中包含大约10-14个外、极性细胞和2-6个内、非极性细胞。
值得指出的是,细胞的命运并不是在囊胚形成的初始阶段就确定的,因为16个细胞外的囊胚在早期阶段仍然保持着以强大的频率成为内细胞团的潜力。
此外,纯外细胞的聚集可以形成一个新的胚胎,能够在子宫中发育,这为这个阶段大量卵裂球的全能性提供了进一步的证据。
在胚胎谱系规范的背景下,一个关键的问题是“内部”或“外部”的空间信息如何被转化为转录程序。
这些基因是由谱系特异性的主调控因子建立的,包括滋养层的Cdx2和Gata3,而不是内细胞团中的Oct4、Sox2和Nanog。
Cdx2缺失的胚胎能够形成滋养外胚层,但需要Cdx2的形态完整性、随后的发育和植入。Tead4的缺失导致囊胚腔形成的完全失败,这一发现使其位于滋养层转录网络的上游。
有趣的是,Tead4的活性不是由特异性表达介导的,而是由Hippo信号级联调控的细胞内定位介导的。Hippo信号通路是一种高度进化保守的通路,在小鼠胚胎中,它将位置信息整合到谱系规范中.
在哺乳动物胚胎中,当Lats1/2磷酸化Yorki同源物Yap1和Wwtr1[36]时,Hippo信号在细胞内就很活跃。
磷酸化的Yap1被排除在细胞核之外并被降解。因此,Yap1不能作为Tead4的共激活剂,导致无法通过表达Gata3和Cdx2来诱导滋养外胚层程序。

在外部细胞中,Lats1/2保持不活跃,使Yap1进入细胞核,并与Tead4结合,使细胞向滋养外胚层运动。
与此相一致的是,早期着床前胚胎中Lats1/2的减少阻止了内细胞团谱系的形成。
河马信号不足以完全控制第一个血统决定。Nf2过表达不能改变Yap定位,可能是因为细胞外中缺失了其他成分。
Lats1/2的敲除导致内细胞团中Cdx2的异位表达,但与Oct4和Nanog的持续表达同时发生,表明内细胞向真正的滋养层的不完全转化。
因此,除了缺乏顶端域外,可能需要额外的信息来建立内细胞团命运。例如,细胞内可能使用缝隙连接介导的细胞间通信和粘附连接,可能通过黏附激酶导致细胞骨架的改变和信号传递活动。
此外,细胞内部可能处于接收信号分子的特权位置。考虑到有限的细胞间空间,即使是少量的分泌配体也会在更高浓度的内部经历。
最后,由于外部细胞中不对称的蛋白质定位,细胞内部可能暴露在特定的“基础”环境中。除了河马信号外,“内部”需求的功能证据来自于在隔离的中生长的卵裂球。
在前5个细胞分裂1/32后分离卵裂球,进行谱系标记表达谱分析,并与内细胞团和滋养外胚层细胞进行比较。
虽然它们的表达模式与两者不同,但它比内细胞团更接近滋养外胚层,证实了内细胞团规范对内部环境的要求。本研究还表明,在桑葚胚聚集中,单个囊胚优先参与滋养层。
有趣的是,Hippo信号是在单个的卵裂球中被诱导的,这表明顶端-基底极性的丧失不足以采用内细胞团的命运。支持这一观点的是,当卵裂球作为单细胞转移到受体女性体内时,它有能力产生功能性滋养层,但不形成胚胎组织。
在去除透明带的4细胞阶段的胚胎在培养过程中可以将其细胞重新排列成各种结构。
与细胞间相互作用最小的四面体结构相比,细胞间相互作用较低的四面体构型,导致内细胞团细胞明显减少,在转移到子宫时表现出发育较差。
单一的1/4和1/8的囊胚球产生“囊胚”的频率分别为40%和15%,而空的滋养层囊泡的数量增加了。
总的来说,这些数据表明,尽管失去了顶端-基底极性,但孤立生长的囊胚,变得偏向于滋养外胚层,不能进入胚胎谱系。
早期内细胞团的一个被广泛低估的特征是其全能性。在这种情况下,我们将全能性定义为一个细胞对所有胚胎和胚胎外谱系做出贡献的能力。
显然,这种全能性不同于受精卵的“绝对”全能性,受精卵能够从一个细胞形成整个生物体。
但从早期囊胚中分离出来的内细胞团s具有再生滋养外胚层的能力,形成小型囊胚,并在体外移植时可分化为滋养外胚层。
此外,它们可以促进内细胞团-桑葚聚集的滋养外胚层。
几种孤立的内细胞团的聚集可以补偿细胞数量,并调节它们的联合大小,以产生明显正常的囊胚。
引人注目的是,超过三分之一的聚集物在转移到受体雌性小鼠后产生完整的卵柱。最近的一项研究测试了内细胞团细胞在不同囊胚阶段的发育潜力,发现早期内细胞团细胞在注射到桑葚胚中时经常参与滋养层,证实了之前观察到的发育可塑性。
在后,当内细胞团细胞数量超过约16-19个细胞时,这种能力逐渐丧失,伴随着小鼠胚胎的第二谱系决定:多能外胚层和原始内胚层的分离。
参考文献[1]敲低PTEN表达对纺锤体正常结构的破坏作用及其相关机制研究[J].孙卓;卢今奇;吴牧雨;李明岩;邢月萍;吴永平.徐州医科大学学报,2018(09)
[2]纺锤体检验点蛋白在卵母细胞减数分裂过程中的研究进展[J].张越;孙洪亮;王成祥;种海玲;李清春.中国当代医药,2021(28)
[3]浅谈动物细胞有丝分裂中的有星纺锤体[J].朱倩倩;俞如旺.生物学教学,2017(09)
[4]纺锤体检验点的信号通路及其作用[J].王建英;兰邹然;杨桂文;李云龙.山东医药,2006(16)
[5]成功地分离出保持机能的纺锤体[J].高庆生.生物学通报,1986(09)