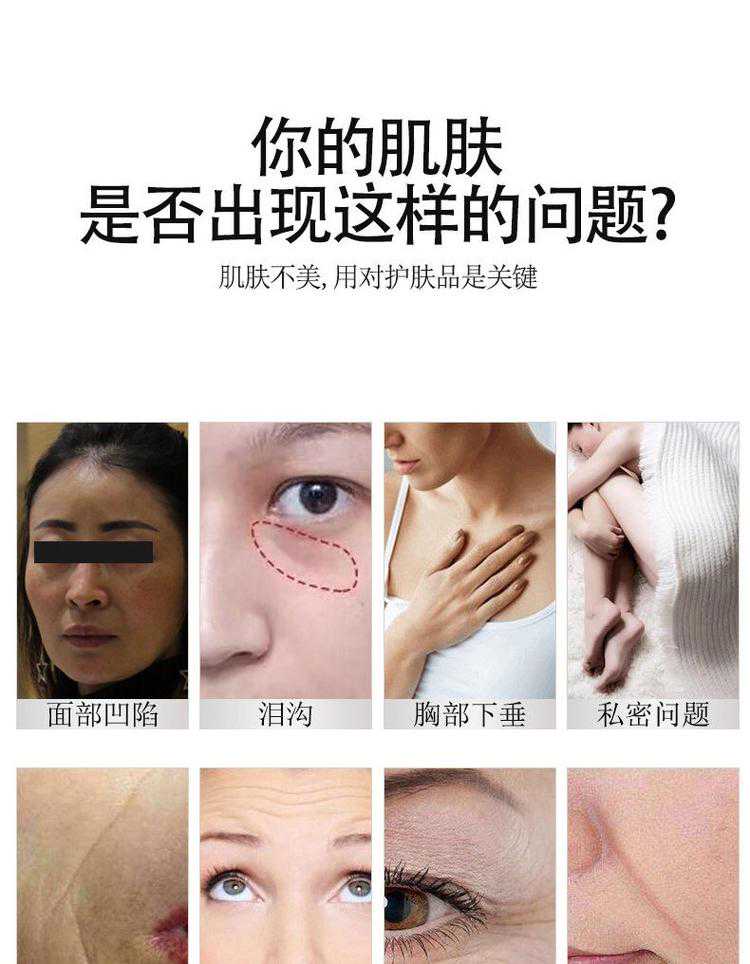
关节的解剖结构包括关节软骨、软骨下骨,滑液以及周围韧带。关节的这一结构组成及特点保证机体具备良好的活动度及应力承载特性。关节软骨发生损伤时,若治疗不当则导致全层骨软骨缺损,并最终导致关节退变,引起骨关节炎(OA)的发生。
在美国,60岁以上人群中关节病变发生率达37%,持续性关节疼痛及伴随着运动功能障碍显著降低人们的生活质量。目前针对局部关节软骨损伤的治疗主要包括微创手术修复、自体软骨移植及干细胞治疗等。而上述治疗均存在一定局限性,表现为治疗后运动功能恢复不佳,组织力学承载性能不足等问题。近几年,3D打印组织工程技术的发展有望成为关节软骨损伤新的替代治疗方案。
因此,来自波兰华沙大学的CostantiniM和ŚwięszkowskiW教授团队模拟软骨的异质性结构及胞外基质组成,通过多个微流控打印头(MPH),将多种材料注入挤压器,最终混合于打印机同轴喷嘴中,通过3D打印技术实现仿生软骨的分层分区结构(透明软骨层及钙化软骨层)。
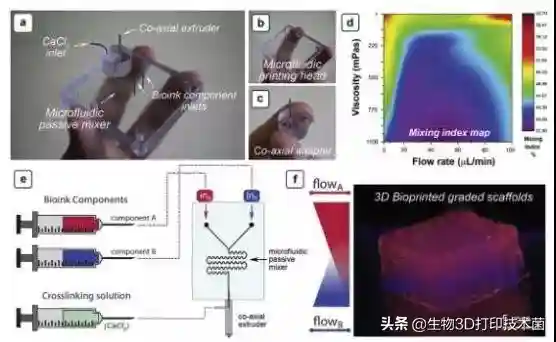
Figure1.(a)Microfluidicextrusionsystemcomposedof(b)themicrofluidicprintingheadand(c)theco-axialadapter.(d)(e)and(f)itisshownschematicallyhowto3Dbioprintgradedscaffolds.
首先研究者通过3D生物打印技术,依据关节软骨的结构特征,仿生构建区域差异性关节软骨,包括透明软骨及钙化软骨。研究者设计的微流控3D生物打印系统()由MPH()及同轴适配器()组成。混合指数(MI)热力图显示流速能影响材料的混合指数(),即流体速度越快,则混合指数越低。研究者实验中以海藻酸盐为基础生物墨水,混合两种不同荧光磁珠(),通过3D打印构建出垂直方向梯度渐变的水凝胶结构()。
以上研究表明微流控3D生物打印系统能有效构建连续渐变的3D结构支架。本研究中,作者模拟软骨组织结构特征,用两种生物墨水打印出两层软骨结构,即透明软骨区及钙化软骨区()。
另外,保持细胞活性是生物打印成功的前提,本研究中,第一个生物墨水用于模拟透明软骨区,作者以海藻酸混合GelMA及CS-AEMA为基质,其上分别种植hMSCs(HC1)或者HMSCs混合hACs(HC2)。第二个生物墨水用于模拟钙化软骨区,作者以透明质酸盐及磷酸三钙为基质,其上种植少量hMSCs(CC)。通过活死染色(),计算出细胞平均存活率分别是92%(HC1)、92%(HC2)、88%(CC),并且生物墨水粘度越低、交联条件越温和,细胞存活率越高。当三组细胞培养7天后,细胞存活率均略有下降,但组间比较无显著差异()。
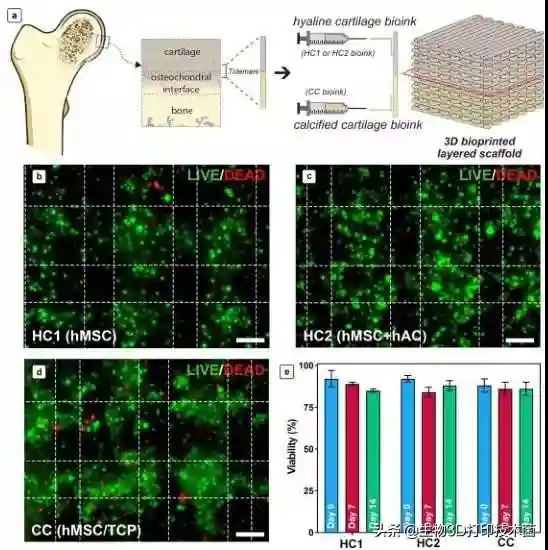
Figure2.(a)Zonalstructureoftheosteochondralinter/deadassaysperformedafterbioprinting:(b)HC1;(c)HC2;(d)CC.(e)Quantifiedviabilityafterbioprinting(day0)andduringinvitrocultureinchondrogenicmedium.
研究者通过共聚焦及μCT分析该分层支架中两种生物墨水的空间分布情况。可见蓝色标记的软骨细胞局限分布于透明软骨区,磷酸三钙微粒(图中小暗点)主要沉积于钙化软骨区。中μCT清晰显示磷酸三钙在支架中的分布(白箭头所指)情况,并能直观看到通过微流控3D生物打印系统制作的高保真分层3D仿生支架。
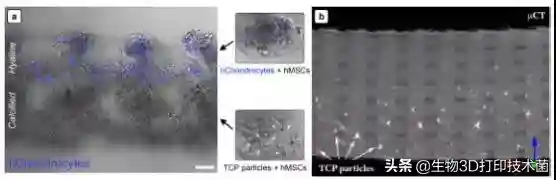
rintedlayeredscaffold.
生物墨水的组成往往影响干细胞成软骨分化行为。研究者通过RT-qPCR()及ICC()分析生物墨水梯度差异及支架结构的梯度渐变对软骨形成的影响。研究发现,细胞培养21天后COL2表达增加了三倍()。hAC/hMSC混合培养的支架中ACAN的表达是单独hMSCs培养的支架中ACAN表达的40倍()。hAC/hMSC混合培养的支架中COL1的表达显著高于单纯hMSC培养的支架中COL1的表达(),而加入hACs共培养后COL2/COL1表达比率增加了两倍(),这是形成透明软骨的标志。此外,加入hACs共培养后COL2/COL10表达比率增加了四倍()。
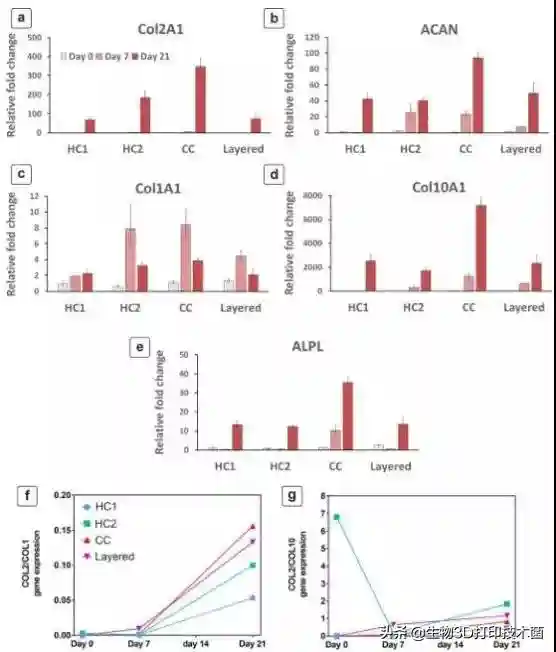
(a),aggrecan(b),collagentype1(c),collagentype10(d)andalkalinephosphatase(e)duringinvitrochondrogenicdifferentiationfor21dmeasuredbyRT-qPCRanalysis.
研究者进一步通过免疫组化检测各组软骨细胞胞外基质的分泌情况。研究结果发现hMSCs/hACs混合培养支架或混合磷酸三钙支架中ACAN及COL2的荧光信号显著增强,COL1及COL10的荧光信号无显著差异()。
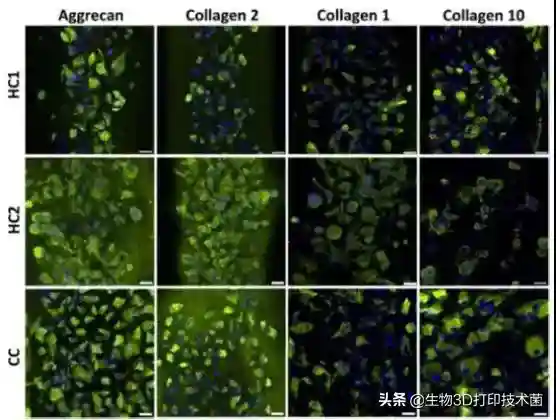
,collagentype2,1and10(green)producedbyhMSC(HC1andCC)andhMSCco-culturedwithhAC(HC2)after21daysofchondrogenicinduction.
最后,研究者将3D打印仿生软骨植入大鼠膝关节内,十二周后进行组织学分析。HE染色发现植入仿生软骨的大鼠股骨滑车沟内可见分化的软骨细胞,对照组则无明显软骨细胞生长()。马森染色提示在分化的软骨细胞周围有来自再生软骨及腱生蛋白的基质沉积()。相比较而言,对照组中COL2及腱生蛋白无明显阳性表达(,j)。进一步通过LaminA/C抗体标记hMSCs及hAC发现植入3D组织工程支架能显著促进软骨修复(,l)。
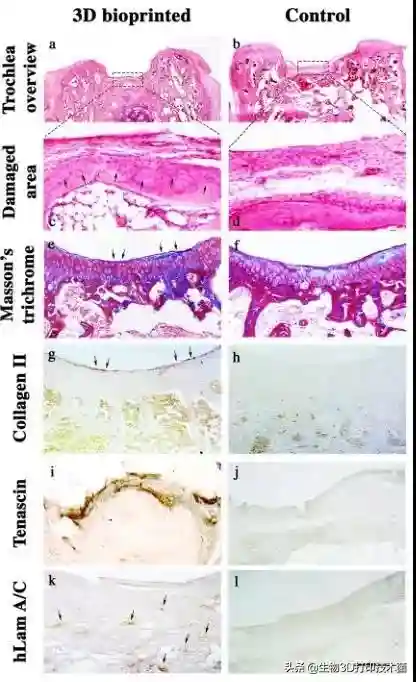
ha3Dbioprintedconstruct.
综上,本研究作者通过微流控3D生物打印系统设计出细胞及材料梯度渐变的仿生骨软骨支架用于修复全层骨软骨缺损。在ALG+GelMa+CS-AEMA水凝胶表面混合培养hMSC及hAC较单纯培养hMSC更能促进透明软骨相关表型的表达,而添加丙烯酸甲酯透明质酸及磷酸三钙则能促进软骨细胞肥厚性增生以及成骨相关基因ALPL及COL10的表达。可以认为这一成果将有助于异质性组织(如骨软骨界面)工程支架的构建。
该研究由波兰华沙大学的CostantiniM和ŚwięszkowskiW教授团队共同完成,于2019年7月发表于Biofabrication。
论文链接: